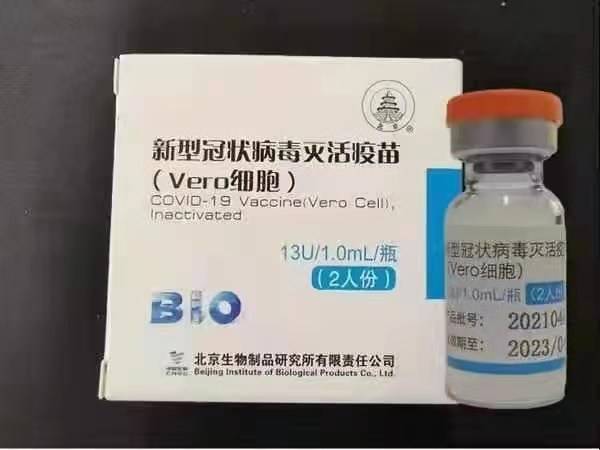
Sinopharm (Pékin) : BBIBP-CorV
LA PHASE 1
1 essai
ChiCTR2000032459
Chine
PHASE 2
2 essais
NCT04962906
Argentine
ChiCTR2000032459
Chine
PHASE 3
6 épreuves
NCT04984408
ChiCTR2000034780
Emirats Arabes Unis
NCT04612972
Pérou
NCT04510207
Bahreïn, Égypte, Jordanie, Émirats arabes unis
NCT04560881, BIBP2020003AR
Argentine
NCT04917523
Emirats Arabes Unis
Approbations
Liste d'utilisation d'urgence de l'OMS 59 pays
Angola、Argentine、Bahreïn、Bangladesh、Biélorussie、Belize、Bolivie (État plurinational de)、Brésil、Brunéi Darussalam、Cambodge、Cameroun、Tchad、Chine、Comores、Égypte、Guinée équatoriale、Gabon、Gambie、Géorgie、Guyane、Hongrie、ndonésie 、Iran (République islamique d')、Irak、Jordanie、Kirghizistan、République démocratique populaire lao
Liban、Malaisie、Maldives、Mauritanie、auritius、Mongolie、Monténégro、Maroc、Mozambique、Namibie、Népal、Niger、Macédoine du Nord、Pakistan、Paraguay、Pérou、Philippines、République du Congo、énégal、Serbie、Seychelles、Sierra Leone、Solomon Îles、Somalie、Sri Lanka、Thaïlande、Trinité-et-Tobago、Tunisie、Émirats arabes unis、Venezuela (République bolivarienne du)、Viet Nam、Zimbabwe
Sinopharm BBIBP-CorV COVID-19 est un vaccin inactivé fabriqué à partir de particules virales cultivées en culture dépourvues de pouvoir pathogène. Ce vaccin candidat a été développé par Sinopharm Holdings et le Beijing Institute of Biological Products.
Le vaccin Sinopharm BBIBP-CorV agit en permettant au système immunitaire de produire des anticorps contre le coronavirus bêta SARS-CoV-2. Des vaccins à virus inactivés sont utilisés depuis des décennies, comme le vaccin contre la rage et le vaccin contre l'hépatite A. Cette technologie de développement a été appliquée avec succès à de nombreux vaccins bien connus, tels que le vaccin contre la rage.
La souche SARS-CoV-2 de Sinopharm (souche WIV04 et numéro de bibliothèque MN996528) a été isolée d'un patient à l'hôpital Jinyintan de Wuhan, en Chine. Le virus a été propagé en culture dans une lignée cellulaire Vero compétente, et le surnageant des cellules infectées a été inactivé avec de la -propiolactone (1:4000 vol/vol, 2 à 8°C) pendant 48 heures. Après clarification des débris cellulaires et ultrafiltration, une seconde inactivation de la β-propiolactone a été réalisée dans les mêmes conditions que la première inactivation. Selon l'OMS, le vaccin a été adsorbé sur 0,5 mg d'alun et chargé dans des seringues préremplies dans 0,5 ml de solution saline stérile tamponnée au phosphate sans conservateur.
Le 31 décembre 2020, la State Drug Administration a annoncé l'approbation du vaccin expérimental développé par Sinopharm.
Le 7 mai 2021, l'Organisation mondiale de la santé a annoncé l'approbation du vaccin. La liste d'utilisation d'urgence de l'OMS a permis aux pays d'accélérer leurs propres approbations réglementaires pour importer et administrer le vaccin COVID-19. Le Groupe consultatif d'experts de l'OMS sur les stratégies de vaccination a également terminé son examen du vaccin. Sur la base de toutes les preuves disponibles, l'OMS recommande deux doses de vaccin, à trois à quatre semaines d'intervalle, pour les adultes de 18 ans et plus. L'efficacité du vaccin contre les maladies symptomatiques et hospitalisées est estimée à 79 % toutes tranches d'âge confondues.
L'American Medical Association a publié « A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Ssympto COVID-19 Infection in Adults » le 26 mai 2021, concluant que « dans cette analyse intermédiaire prédéfinie d'un essai clinique randomisé, adultes Les 2 vaccins inactivés contre le SRAS-CoV-2 administrés dans cette analyse intermédiaire prédéfinie d'essais cliniques randomisés ont considérablement réduit le risque de COVID-19 symptomatique, et les événements indésirables graves étaient rares. » Dans cet essai randomisé de phase 3 chez l'adulte, l'efficacité des 2 vaccins à virus entier inactivé dans les cas symptomatiques de COVID-19 était de 72,8% et 78,1%, respectivement. 2 vaccins ont eu des événements indésirables graves rares avec une fréquence similaire à celle du groupe témoin alun uniquement, et la plupart n'étaient pas liés à la vaccination. Une analyse exploratoire a révélé que les 2 vaccins induisaient des anticorps neutralisants mesurables, similaires aux résultats de l'essai de phase 1/2.
Le groupe de travail SAGE de l'OMS a publié une revue du vaccin Sinopharm/BBIBP COVID-19 le 10 mai 2021. Le vaccin COVID-19 de GAVI intègre un moniteur de flacon de vaccin qui indique aux agents de santé si le vaccin a été stocké correctement et n'a pas été exposé à surchauffe. En conséquence, des dommages, a signalé GAVI le 14 mai 2021. les étiquettes intelligentes fabriquées par Zebra Technologies et fabriquées par Temptime Corporation, consistent en un cercle avec un carré de couleur plus claire au milieu, constitué d'un produit chimique incolore qui développe de manière irréversible une couleur au fil du temps . Celui-ci s'assombrit pour donner une indication visuelle de l'exposition cumulée à la chaleur. Une fois que le flacon a été exposé à la chaleur au-delà de sa plage de stockage optimale, le carré devient plus sombre que le cercle, indiquant que le vaccin ne doit plus être utilisé.
Numéro d'enregistrement de la bibliothèque de médicaments du vaccin national BBIBP-CorV COVID-19 : DB15807.